Page 87 कक्षा 8वीं रसायन विज्ञान नोट्स पदार्थ: धातु और अधातु
1. पदार्थों को मोटे तौर पर दो समूहों धातु और अधातु में बांटा जा सकता है।
2. पदार्थ जो आम तौर पर कठोर, चमकदार, निंदनीय, ध्वन्यात्मक और गर्मी और बिजली के अच्छे संवाहक होते हैं, धातु होते हैं।
उदाहरण के लिए, तांबा, लोहा, सोना, चांदी, आदि।
3. पदार्थ जो आम तौर पर नरम, दिखने में सुस्त, भंगुर, गैर-ध्वनिक और गर्मी और बिजली के खराब संवाहक होते हैं, अधातु होते हैं।
उदाहरण के लिए ऑक्सीजन, हाइड्रोजन, कार्बन, सल्फर आदि।
4. धातुओं का वह गुण जिसके द्वारा उन्हें पीटकर पतली चादर में बदला जा सकता है आघातवर्धनीयता कहलाती है।
5. धातु का वह गुण जिसके द्वारा उसे खींचकर तार बनाया जा सकता है, तन्यता कहलाती है।
6. धातु का ध्वनि उत्पन्न करने का गुण सोनोरिटी कहलाता है।
🖋 धातुओं और अधातुओं के रासायनिक गुण:
(i) ऑक्सीजन के साथ प्रतिक्रिया: धातु और अधातु दोनों ही ऑक्सीजन में जलने पर अपने ऑक्साइड बनाते हैं। धातुएँ क्षारीय ऑक्साइड बनाती हैं जबकि अधातु सामान्यतः अम्लीय ऑक्साइड बनाती हैं।
धातु या अधातु की ऑक्सीजन के साथ होने वाली अभिक्रिया को ऑक्सीकरण अभिक्रिया कहते हैं।
(ii) जल से अभिक्रिया: धातुएँ जल से अभिक्रिया करके अपने ऑक्साइड या हाइड्रॉक्साइड तथा हाइड्रोजन गैस उत्पन्न करती हैं। अधातु जल से अभिक्रिया नहीं करते हैं।
(iii) अम्लों के साथ अभिक्रिया: धातुएँ अम्लों से अभिक्रिया करती हैं और धातु लवण तथा हाइड्रोजन गैस उत्पन्न करती हैं। हाइड्रोजन गैस 'पॉप' ध्वनि के साथ जलती है, जब जलती हुई माचिस की तीली उसके पास लाई जाती है।
अधातु सामान्यतः अम्लों से अभिक्रिया नहीं करते हैं।
(iv) क्षारों के साथ अभिक्रिया:अधिकांश धातु और अधातु सामान्यतः क्षारों से अभिक्रिया नहीं करते हैं। एल्युमिनियम, लेड और जिंक जैसी कुछ धातुएँ सोडियम हाइड्रॉक्साइड जैसे प्रबल क्षारों से अभिक्रिया करके जटिल लवण और हाइड्रोजन गैस बनाती हैं। इसी प्रकार, कभी-कभी अधातुओं और क्षारों के बीच कुछ जटिल अभिक्रियाएँ होती हैं।
🖋विस्थापन अभिक्रियाएँ- ऐसी अभिक्रियाएँ जिनमें अधिक क्रियाशील धातु कम क्रियाशील धातु को उसके लवण से विस्थापित कर देती है, विस्थापन अभिक्रिया कहलाती है।
कुछ धातुएँ अन्य धातुओं को उनके विलयनों से विस्थापित करने में सक्षम होती हैं। उदाहरण के लिए, जिंक (Zn) कॉपर सल्फेट विलयन से कॉपर की जगह लेता है। प्रतिक्रिया इस प्रकार है:
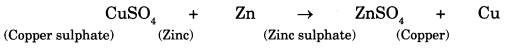
🖋 क्रियाशीलता श्रेणी : धातुओं की अभिक्रियाशीलता के आधार पर एक क्रम बनता है जिसे क्रियाशीलता श्रेणी कहते हैं। श्रृंखला के शीर्ष पर धातु सबसे अधिक प्रतिक्रियाशील होते हैं और नीचे वाले सबसे कम प्रतिक्रियाशील होते हैं। कॉपर और आयरन की तुलना में जिंक अधिक अभिक्रियाशील है। एक अधिक प्रतिक्रियाशील धातु एक कम प्रतिक्रियाशील धातु को प्रतिस्थापित कर सकती है लेकिन एक कम प्रतिक्रियाशील धातु एक अधिक प्रतिक्रियाशील धातु को प्रतिस्थापित नहीं कर सकती है।
🖋 धातुओं का उपयोग:
धातुओं का उपयोग मशीनरी, ऑटोमोबाइल, हवाई जहाज, रेलगाड़ी, उपग्रह, औद्योगिक उपकरण, पानी के बॉयलर, बर्तन आदि बनाने में किया जाता है। इनका उपयोग तार और चादरें बनाने में भी किया जाता है।
🖋 अधातुओं के उपयोग
• सांस लेने के दौरान सभी जीवित प्राणी ऑक्सीजन लेते हैं, जो एक अधातु है।
• पौधों की वृद्धि को बढ़ाने के लिए उर्वरकों में नाइट्रोजन, फास्फोरस और पोटेशियम जैसी गैर-धातुओं का उपयोग किया जाता है।
• अ-धातु जैसे क्लोरीन का उपयोग जल शोधन प्रक्रिया में किया जाता है।
• बैंगनी रंग के घोल में अधातु का उपयोग किया जाता है जिसे घावों पर एंटीसेप्टिक के रूप में लगाया जाता है।
•पटाखों में गैर-धातुओं का उपयोग किया जाता है।
परमाणु: एक परमाणु किसी तत्व का सबसे छोटा कण होता है जिसे किसी भौतिक माध्यम से और विभाजित नहीं किया जा सकता है।
चालक (Conductor) : वह पदार्थ जो अपने में से होकर ऊष्मा और विद्युत को प्रवाहित होने देता है, चालक कहलाता है।
विस्थापन अभिक्रिया: वह अभिक्रिया जिसमें अधिक क्रियाशील तत्व कम क्रियाशील तत्व को विस्थापित कर देता है, विस्थापन अभिक्रिया कहलाती है।
तन्यता (Ductility) : धातुओं का वह गुण जिसके कारण उन्हें खींचकर तार बनाया जा सकता है, तन्यता कहलाती है। धातुएँ तन्य होती हैं।
तत्व: वे पदार्थ जिनके अणु केवल एक ही प्रकार के परमाणुओं से बने होते हैं, तत्व कहलाते हैं।
कठोरता (Hardness): किसी पदार्थ का वह गुण जिसके कारण उसे आसानी से नहीं काटा जा सकता, उसकी कठोरता कहलाती है। धातुओं में यह गुण होता है।
आघातवर्ध्यता (Mallibility) : किसी पदार्थ का वह गुण जिसके कारण उसे पीटकर पतली चादर में परिवर्तित किया जा सकता है, आघातवर्धनीयता कहलाती है। धातुओं में यह गुण होता है।
धातुएँ: पदार्थ जो आमतौर पर चमकदार, कठोर, निंदनीय, तन्य, ध्वन्यात्मक और ऊष्मा और बिजली के अच्छे संवाहक होते हैं, धातु होते हैं।
उपधातु : वे पदार्थ जिनमें धातु और अधातु दोनों के गुण होते हैं, उपधातु कहलाते हैं। उदाहरण के लिए, बिस्मथ, सुरमा, आर्सेनिक और बोरान।
अधातु (Non-metals): वे पदार्थ जो मुलायम, दिखने में फीके, अध्वनिक तथा ऊष्मा तथा विद्युत के कुचालक होते हैं, अधातु कहलाते हैं। हथौड़े से थपथपाने पर वे पाउडर के रूप में टूट जाते हैं। ये इलेक्ट्रॉन ग्रहण कर ऋणात्मक आयन भी बनाते हैं।
ध्वन्यात्मकता (Sonorous) : धातुओं के जिस गुण के कारण ध्वनि उत्पन्न होती है, उसे सोनोरिटी कहते हैं। इसलिए धातुओं को ध्वन्यात्मक कहा जाता है।
उत्कृष्ट गैसें: उत्कृष्ट गैसें, जिन्हें अक्रिय गैसें भी कहा जाता है, रासायनिक तत्वों का एक समूह है जिनकी कम अभिक्रियाशीलता होती है। ये आवर्त सारणी के समूह 18 में पाई जाती हैं।
उत्कृष्ट गैसें हीलियम, निऑन, आर्गन, क्रिप्टन, ज़ेनॉन, रेडॉन और ओगेनेसन हैं।
ये तत्व आमतौर पर रंगहीन, गंधहीन और एकपरमाणुक गैसें होती हैं जिनका इलेक्ट्रॉन विन्यास अत्यंत स्थिर होता है, जिससे ये रासायनिक बंध बनाने में अनिच्छुक होती हैं।
हीलियम (He): प्राकृतिक गैस भंडारों में पाया जाता है और गुब्बारों, क्रायोजेनिक्स और डाइविंग मिश्रणों में उपयोग किया जाता है।
नियॉन (Ne): विज्ञापन संकेतों और प्रकाश व्यवस्था में उपयोग किया जाता है।
आर्गन (Ar): वेल्डिंग, प्रकाश व्यवस्था और एक सुरक्षात्मक गैस के रूप में उपयोग किया जाता है।
क्रिप्टन (Kr): कुछ प्रकार के प्रकाश और लेज़रों में उपयोग किया जाता है।
ज़ेनॉन (Xe): विशेष प्रकाश व्यवस्था, चिकित्सा इमेजिंग और कुछ रॉकेट इंजनों में एक घटक के रूप में उपयोग किया जाता है।
रेडॉन (Rn): एक रेडियोधर्मी गैस, जो प्राकृतिक रूप से पाई जाती है और कुछ चिकित्सा उपचारों में उपयोग की जाती है।
कुछ रासायनिक समीकरण
- CO2 + H2O → C6H12O6 + O2
- SiCl4 + H2O → H4SiO4 + HCl
- Al + HCl → AlCl3 + H2
- Na2CO3 + HCl → NaCl + H2O + CO2
- C7H6O2 + O2 → CO2 + H2O
- Fe2(SO4)3 + KOH → K2SO4 + Fe(OH)3
- Ca3(PO4)2 + SiO2 → P4O10 + CaSiO3
- KClO3 → KClO4 + KCl
- Al2(SO4)3 + Ca(OH)2 → Al(OH)3 + CaSO4
- H2SO4 + HI → H2S + I2 + H2O
The End
कृप्या इस लेख को अधिक - से - अधिक शेयर करदें ।

